FDA 開發途徑
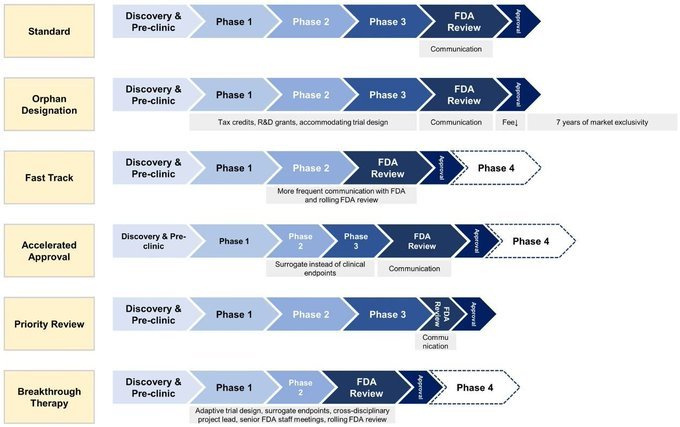
1 ️ ⃣ 標準指定:標準指定是藥物開發的典型途徑,涉及臨床前研究和三個階段的臨床試驗,以徹底評估安全和有效性。
2 ️ ⃣ 孤兒指定:此指定為針對罕見疾病的藥物保留,提供稅抵免和營銷專屬性等獎勵措施,以鼓勵服務不足的患者群體發展。
3 ️ ⃣ 快速指定:快速跟踪加快針對未滿足醫療需求的嚴重疾病的藥物開發,允許與 FDA 更頻繁的互動,並有可能加快批准。
4 ️ ⃣ 加速批准:根據代替終點授予嚴重疾病而沒有有效治療,該途徑可以更快地進入市場,需要上市後研究來確認臨床效益。
5 ️ ⃣ 優先審查:優先審查專用於對嚴重疾病的現有治療方法顯著改進的藥物,旨在在六個月內完成 FDA 審查,加快獲得有前途的治療方法。
6 ️ ⃣ 突破性治療指定:專為比現有療法顯著改善的藥物保留,突破治療狀態根據 FDA 指導加快開發,旨在更快為患者帶來創新治療。
來源:尼古拉斯·胡巴茨通過人力資源應用程序上的卡米拉·費迪!
免責聲明:社區由Moomoo Technologies Inc.提供,僅用於教育目的。
更多信息
評論
登錄發表評論
Salmon Klein : 你是否在 $Macrogenics (MGNX.US)$ ?告訴我什麼時候好跳進
MangoXXXX Salmon Klein: 現在
SlowndEasyTrades Salmon Klein: 做你自己的研究,我覺得懸停在底部,買信號從模式即將開始,不要盲目跟隨我


Salmon Klein SlowndEasyTrades: 我等待到 14.8 左右,但我很忙的工作,如果它達到底部而且你在... 任何好的反饋總是非常歡迎兄弟... 只是這樣,所以謝謝
SlowndEasyTrades Salmon Klein: 當日中的雙倍底部可能不會低於 14 點,或者如果是這樣,仍有機會再進行兩個側面交易,反正我下跌了近 25%(原因保持超過頂部)