OCGN
讓我重新整理我的意見供大家參考。
1.有關公司的背景資料
「Ocugen, Inc. 是一家生物製藥公司,致力於發現,開發和商業化基因療法以治愈失明疾病並開發一種疫苗以挽救 COVID-19 的生命。」(根據官方信息,OGN 專門從事開發,研究和商業化(治療眼部疾病並開發疫苗以拯救世界的生物製藥公司)
「Ocugen, Inc. 是一家生物製藥公司,致力於發現,開發和商業化基因療法以治愈失明疾病並開發一種疫苗以挽救 COVID-19 的生命。」(根據官方信息,OGN 專門從事開發,研究和商業化(治療眼部疾病並開發疫苗以拯救世界的生物製藥公司)
1.1 八爪魚與科瓦辛之間的關係
事實上,OGN 和巴拉特生物技術於 2021 年 2 月簽署了一項協議,根據條款, Ocugen 將在美國和加拿大擁有疫苗(Covaxin)的專利權,並將負責美國和加拿大的臨床開發、監管批准(包括 EUA)和市場開發。 商業化。巴拉特生物技術還將提供在美國和加拿大使用的初始劑量。
事實上,OGN 和巴拉特生物技術於 2021 年 2 月簽署了一項協議,根據條款, Ocugen 將在美國和加拿大擁有疫苗(Covaxin)的專利權,並將負責美國和加拿大的臨床開發、監管批准(包括 EUA)和市場開發。 商業化。巴拉特生物技術還將提供在美國和加拿大使用的初始劑量。
此外,Bharat Biotech 將支持美國和加拿大製造技術轉移。 考慮到美國和加拿大市場的獨家許可證,Okugen 將與 Bharat Biotech 在美國和加拿大市場出售 COVAXIN 的利潤分享,Okugen 將保留其 45% 的利潤。
OGNN 現已向加拿大提交 EUA 申請,美國已經提交了 IND 申請,為後續的 BLA 申請奠定了基礎。
2. 加拿大歐盟
2020 年 9 月,加拿大衛生部通過一項決議,加快加拿大處理緊急疫苗使用授權的程序(關於與 COVID-19 有關使用藥物的進口,銷售和廣告的臨時令),然後更改為 COVID-19 新藥物提交。申請人可以在所有試驗結束後向當局申請 EUA,當局也將優先處理他們的申請。
申請人提交的文件必須符合以下條件:
1.臨床前研究(例如動物試驗)
2.臨床研究(所有測試結果 + 安全數據 + 有效數據)
3.製造數據(生產數據:疫苗生產過程)
2.臨床研究(所有測試結果 + 安全數據 + 有效數據)
3.製造數據(生產數據:疫苗生產過程)
目前,通過 Vaccigen 有限公司審查 OGN 在加拿大的 EUA 申請仍在進行中。這恰逢世衛組織剛剛批准 Covaxin 的 EUL 申請。也許我們可以繼續拭目以待。
3 世界衛生組織歐盟與中國通用發展組織的關係
除了美國和 FDA 之外,有些人最近開始討論世界衛生組織 EUL。讓我簡單地解釋一下。世衛組織已於 3/11 正式批准了科瓦欣的 EUL 申請。事實上,巴拉特生物技術直接應用於世衛組織的 EUL。看來它與 OGNN 無關,但是 OGNN 可能會從中受益!
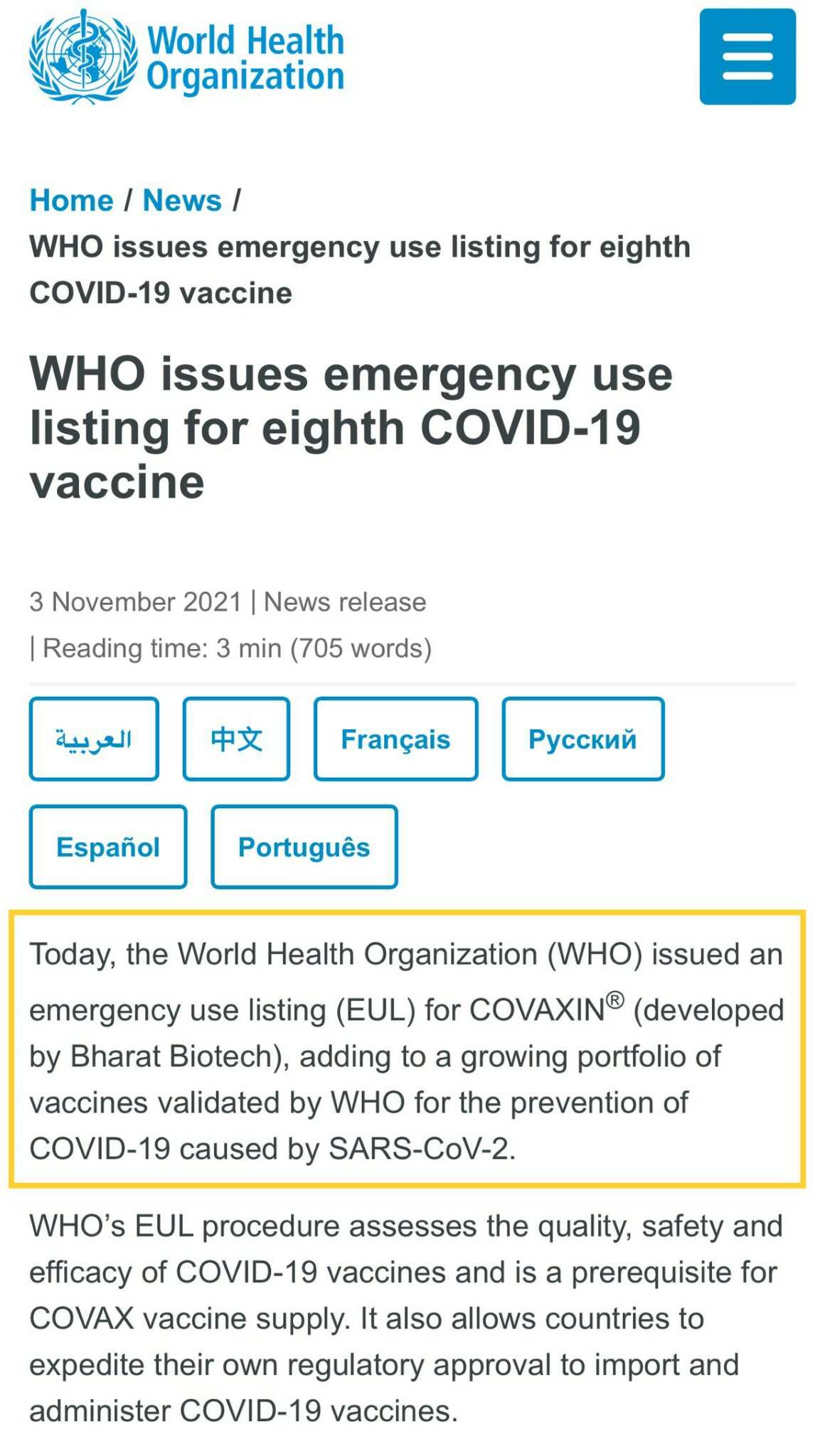
根據 OCNN 和巴拉特生物技術簽署的協議,其中一個條款值得我們關注: 「如果根據商業供應協議要求,並受到 Ocugen 能力的任何合理限制(如商業供應協議中詳述)的限制,在 BBIL 獲得 BBIL 領域的監管批准後,Ocugen 應負責在其商業包裝展示中供應成品的製造和供應。」
簡而言之,在獲得 Bharat Biotech(向加拿大和美國以外地區提供疫苗)的監管機關(世衛組織/其他國家)批准後,OCGN 可以向 Bharat Biotech 提供疫苗。假設巴拉特生物科技獲得世衛組織 EUL,科瓦辛將加入 COVAX(Covid-19 疫苗實施計劃),以協助將疫苗分發到其他國家(尤其是貧窮國家)。由於 EUL,更多國家/地區可能會加快批准 Covaxin 的 EUA 申請(請注意,Bharat Biotech 之前已向 60 多個國家/地區提交 EUA),OCGN 可以利用此機會向其他國家/地區提供疫苗。
4。美國 BLA 申請(BLA 申請的第一步)
OGNN 於 27/10 宣布,已向美國食品藥物管理局提交了一份研究性新藥申請(IND),以探討 Covaxin 的有效性是否適用於美國。這也相當於 OGNN 開始邁出美國 BLA 的第一步。
OGNN 於 27/10 宣布,已向美國食品藥物管理局提交了一份研究性新藥申請(IND),以探討 Covaxin 的有效性是否適用於美國。這也相當於 OGNN 開始邁出美國 BLA 的第一步。

根據 OGNN 提供的信息,假設 IND 申請獲得成功批准,OGN 將在美國正式進行臨床試驗,然後比較美國和印度的試驗結果是否相同。OGN 表示,希望在 2022 年第一季度完成上述測試。但是,每個人都應該清楚地表明,此應用程序僅是在美國進行測試的應用程序,而不是 BLA 的正式申請。
根據 FDA 的數據,IND 意味著該藥物尚未被批准在美國銷售/使用。FDA 將在收到 IND 申請後 30 天內批准該申請。如果 OGN 在 30 天後仍未收到 FDA 的反對意見,則可以在美國進行試驗。
總之,IND 應用程序是 OCGN 將科瓦辛帶到美國的第一步。上述信息也反映了 OCGN 已開始為 BLA 做準備。讓我在這裡補充一點。在許多 BLA 應用條件中,美國的本地測試結果必須是 FDA 是否批准 BLA 的重要組成部分。
免責聲明:社區由Moomoo Technologies Inc.提供,僅用於教育目的。
更多信息
評論
登錄發表評論
Imranm20 : 良好的信息以了解情況
Louou : 非常詳細的解釋!我會密切關注,等待它上升